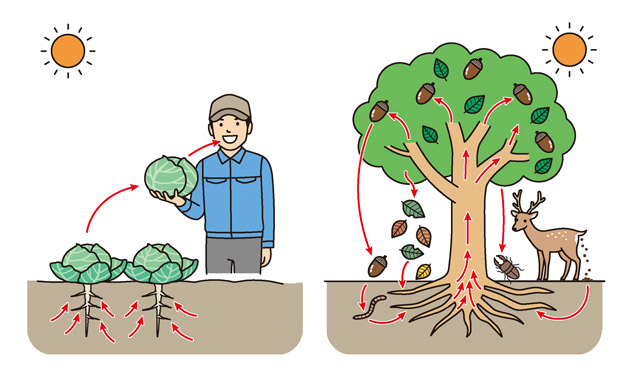
図1 畑と自然との養分の流れの違い
田畑では肥料をやらないと野菜や花はしっかり育たないのに、野山の木々は肥料をやらなくても大きく育つのはなぜでしょう。自然界では植物は葉を落とし、あるいは動物のふんや死骸などが少しずつ分解し、植物が必要とする養分が絶えず補給され、再利用する循環の仕組みが完成しているためです。
しかし、畑などでは動植物の遺骸が絶えず供給されるわけではありません。食べる目的で育てた葉、根、果実、めでる目的で育てた花も収穫した後は、畑の外へ持ち出されます。しかも、多くの作物は人が使いたい部位をより大きくなるようにしたので、自然にある植物よりも多くの養分を使います。作物を収穫するたびに土の中の養分は作物に収奪され減っていきます。なので、不足した養分は肥料により補う必要があるのです。今回は作物が必要な養分と肥料の施し方について2回にわたり触れてみます。
植物は偏食が嫌い
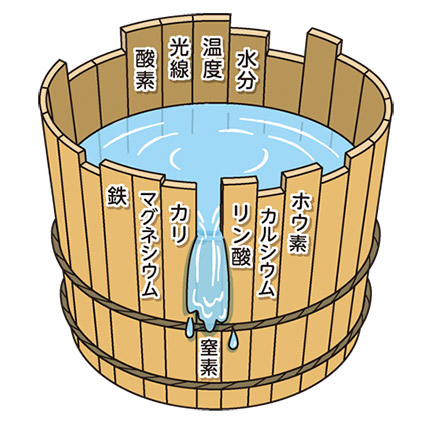
図2 ドベネックの桶
野菜や花が育つためには葉を広げ十分に光合成する必要があります。そのためには根から水分や養分をスムーズに吸収しないとなりません。特に肥料から取り入れる養分は植物体内で物質を作り、生理作用をスムーズに進めるために、過不足なく供給されることが必要です。植物は、必要とする養分がどれか一つでも足りなくなると、ほかの養分の吸収も悪くなり、収量が減るだけでなく、ひどい場合は障害が出てきます。このことを、提案した科学者の名前を冠して「リービッヒの最小(養分)律」といいます。また、これを分かりやすく絵で説明したものが「ドベネックの桶」です。ちなみにドベネックは、「リービッヒの最小(養分)律」を説明するためにこの絵を描いた人の名前です。
植物の体の8%を構成する14種類の必須要素が要
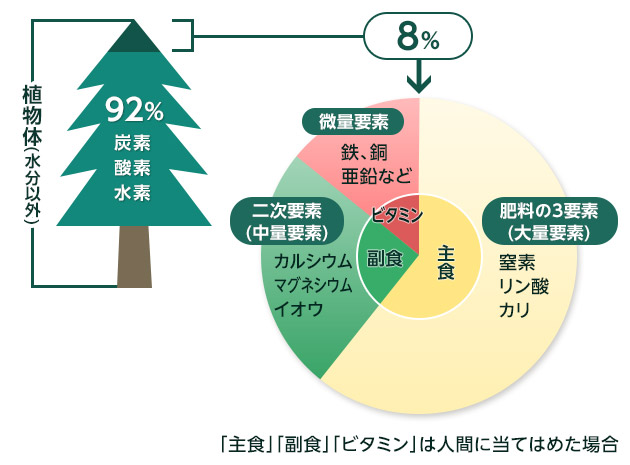
図3 植物を構成する要素の割合
ところで、植物は40種以上のさまざまな要素からできています。特に多く含まれ、植物の生育に欠かせない17種類の要素を「必須要素(元素)」と呼びます。水分を除いた乾物の92%は炭素(C)・酸素(O)・水素(H)です。これらは空気中の炭酸ガスや水から摂取します。残りの8%は、17種類の要素からこの3要素を除いた14種類の成分からできています。
これらの14種類の成分は、肥料によって補う必要があります。その中でも肥料として施すと効果が最も表れやすい窒素(N)、リン酸(P)、カリ(K)は「肥料の3要素(大量要素)」と呼ばれ大量に必要で、植物にとって主食の「ごはん」に当たる重要な要素です。「葉肥」とも呼ばれる窒素は、葉緑素などの主成分で葉や茎の成長を促し、葉の色を濃くします。リン酸は「実肥」ともいい、DNAなど核酸の成分で開花・結実、根の成長を促します。カリは「根肥」ともいい、根や茎葉を強くして耐病性を高めます。いずれも肥料によって積極的に施す必要があります。
14種類の成分から3要素を除いた残り11種類の要素のカルシウム(Ca)、マグネシウム(Mg)、イオウ(S)、鉄(Fe)、マンガン(Mn)、ホウ素(B)、亜鉛(Zn)、銅(Cu)、モリブデン(Mo)、塩素(Cl)、ニッケル(Ni)の要素も微量ですが必要とされます。その中のカルシウム、マグネシウム、イオウは3要素の次に必要な要素で、「二次要素(中量要素)」と呼ばれ、植物にとって副食の「おかず」に当たります。この中のイオウは普通に土に含まれるので施す必要はなく、カルシウムとマグネシウムは苦土石灰を施せば十分補給できます。
残りの8種類の成分は微量要素と呼ばれます。本来は単独で施すものではなく、堆肥、腐葉土などの有機質肥料などで補給できます。ただし、常に補給の必要がある鉄などは単独の肥料もあります。私たちが使うサプリメントといったところでしょうか。各必須要素の働きは下表の通りです。
表1 植物の必須要素とそれらの主な生理作用

土の状態を診断するための2つの数値(pHとEC)
家庭菜園など小規模な作物の栽培で、土壌中の全ての要素の測定や精密な分析をすることは、費用や時間的なことから現実的ではありません。人間ドックや専門的な精密検査をしなくても、定期的に健康診断だけでも受けることが大切なように、pH(ピーエイチ)とEC(イーシー)を定期的に測定するだけでも作物を健全に育てるための指標として役立ちます。pHは土の化学的な性質を表すもので、それがある特定の範囲だと植物はバランスよく食事ができることを意味します。
また、作物の収量は窒素の量が大きく影響し、その施肥量に応じて比例的に収量は向上します。しかし、ある量を超えるとそれも頭打ちになり、やがて低下してしまいます。ECの数値から、間接的に土の中の窒素の量を知り、作物ごとに必要な施肥量を、適切に施すことが大切なのです。
植物が必要とする要素が使える状態か探る(pH)

図4 pHと各要素の溶けやすさ
表は4.0~10.0までpHの数値で表し、真ん中の7.0が中性で、それよりも小さいと酸性、大きいほどアルカリ性が強くなります。肥料分を適度に保持して植物が使えるようにするために、土壌のpHは一般に6.0~6.5の弱酸性が好適で、そこを中心に一般に5.5~7.0の間にあればよいとされています。実際には好適なpHは、植物ごとに微妙に異なるので下の表を参考にpHを矯正します。
表2 作物の生育に適したpHの範囲
| pH領域 | 野菜 | 花き | ||
|---|---|---|---|---|
| 葉菜 | 果菜 | 根菜 | ||
| 6.5~7.0 微酸性~中性領域で生育 |
エンドウ カリフラワー※2 キャベツ※2 タマネギ※2 ホウレンソウ※4 |
キュウリ※2 トマト※3 |
サトイモ※2 ニンジン※2 |
ガーベラ カスミソウ スイートピー トルコギキョウ |
| 6.0~6.5 微酸性領域で生育 |
アスパラガス ウド カリフラワー※2 キャベツ※2 シュンギク セルリー タカナ タマネギ※2 ナバナ ニラ ネギ ハクサイ パセリ ブロッコリー ホウレンソウ※4 ミツバ ミョウガ モロヘイヤ レタス |
インゲン エダマメ オクラ カンピョウ キュウリ※2 ササゲ スイートコーン ソラマメ トウガラシ トマト※3 ナス ピーマン メロン ラッカセイ |
コンニャク サトイモ※2 ジャガイモ※1 ダイコン※3 ニンジン※2 ヤマノイモ |
カーネーション キク グラジオラス サイネリア シクラメン スイセン スターチス ストック ゼラニウム パンジー フリージア ポインセチア マダガスカル ジャスミン ユリ |
| 5.5~6.5 微~弱酸性の広い領域で生育 |
カリフラワー※2 キャベツ※2 コマツナ サラダナ タマネギ※2 チンゲンサイ フキ |
イチゴ カボチャ キュウリ※2 スイカ |
コカブ ゴボウ サトイモ※2 ジャガイモ※1 タマネギ ニンジン※2 レンコン |
アンスリウム コスモス マリーゴールド |
| 5.5~6.0 弱酸性領域で生育 |
カリフラワー※2 キャベツ※2 タマネギ※2 |
キュウリ※2 | サツマイモ サトイモ※2 ジャガイモ※1 ショウガ ニンジン※2 ニンニク ラッキョウ |
セントポーリア プリムラ |
| 5.0~5.5 酸性領域で生育 |
ジャガイモ※1 | アナナス シダ 洋ラン ベゴニア リンドウ |
||
※1:pH5.0~6.5 ※2:pH5.5~7.0 ※3:pH6.0~7.0 ※4:pH6.0~7.5 ※5:ダイコンの適正値はpH6.0~6.5だが、適応性は広く5.0~7.0でも可
(2019年9月24日にダイコンを改訂しました)
なぜ、植物の成長のためにpHが5.5~7.0の間にあるとよいかというのは図4の下の部分の通りです。それぞれの要素は、太い部分で水に溶けるイオンの形になりやすくなります。植物は成長に必要な要素がイオンの形になることでそれらを根から吸収して、養分として使えるようになります。これに対し細くなるほど今度は水に溶けない、つまり不溶化して植物が使えない形になります。土壌のpHが酸性寄りの場合、例えばpH5.0のとき、植物は鉄・マンガン・亜鉛・銅などの要素は利用できますが、他の要素は利用できなくなることが分かります。
反対にアルカリ性寄りになったときはその逆のことが起こります。特にリン酸はアルカリ性でリン酸カルシウムになり、不溶化することで植物は使えなくなってしまいます。また、施設栽培などで雨にさらされないことで乾燥状態になった場合でも施した肥料の成分が集積しても土はアルカリ性になってしまうことがあります。
土のpHを知ることで、植物が養分として必要な要素が使える状態なのか判断することができます。pHは、市販のpHメーターなどで簡単に測定することができますので、1年に1回程度は測定しましょう。

図5 pHを測定するための道具(左:土壌酸度計、右:土の酸度を測定するキット)
酸度測定液を用いたpHの測定

図6 酸度測定液によるpH測定手順
①畑では四隅から深さ15cm程度の土を、コンテナ栽培の場合は全ての用土を混ぜた土を、カップに土1、水道水2の割合で入れる。
②よく混ぜる。
③土やごみを除いた上澄み液を専属の試験管に2.5mL取り、測定液を3滴添加し、試験管にふたをしてよく振る。
④pHに応じて色が変わるので、比色表でpHを確認する。
必要な窒素の量を探る(EC)

図7 ECメーター
EC(Electrical Conductivity)は、「電気伝導度」ともいい、水に溶けた塩類(多くの要素)の総量を表した数値で、単位はmS/cm(ミリジーメンスパーセンチメートル)あるいはdS/m(デシジーメンスパーメートル)で表します。ECの数値は、土の中の窒素(N)分である硝酸態窒素との関係性が特に高く、ECが高ければ窒素量が多く、低いと少ないことが分かります。土の種類によって微妙に数値は異なりますが、目安として0.4~1.2のときは適正で、0.3以下のときは窒素成分が足りなく、1.3以上は過剰といえます。ECは、ECメーターで簡単に測定できます。ネット通販などで3000円程度のものが入手できるので、一つ持っておくとよいでしょう。
なぜ土が酸性になるのか?
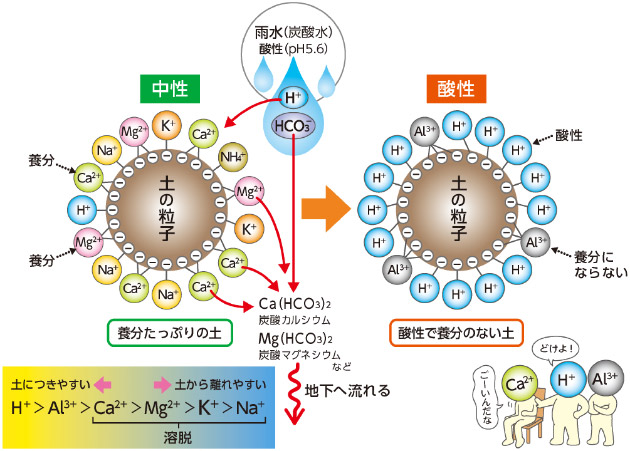
図8 雨水による土の酸性化
そもそもどうして土はpHが低い酸性になるのでしょうか。その理由は2つあります。土を構成する土の粒子(土壌コロイド)はマイナスに帯電しています。土の粒子の周りにマイナスの性質を持った椅子がぎっしり置かれている感じです。一方でカルシウム、マグネシウム、カリウムなど多くの要素は陽イオンの状態で存在しプラスの性質を持っています。マイナスの椅子にプラスの要素たちが磁石のプラスとマイナスのように引き合って座っているようなイメージです。このとき同じプラスの性質を持つ水素イオン(H+)や栄養のないアルミニウムイオン(Al3+)は、椅子取りゲームにめっぽう強いことを覚えておいてください。
問題は雨です。雨水は空気中の炭酸ガスを吸収してpH5.6前後の酸性の炭酸水になっています。シュワシュワすることはありませんが、この炭酸水には酸性の水素イオンと炭酸水素イオン(HCO3-)が含まれています。椅子取りのうまい酸性の水素イオンや栄養のないアルミニウムイオンは、アルカリ性のカルシウムやマグネシウムイオンを追い出して椅子にどんどん座っていきます。そのため土の粒子もどんどん酸性になっていきます。そして追い出されたカルシウムたちは炭酸水素イオンと結合して炭酸カルシウムなどになって地下へ雨水と一緒に流されてしまいます。このようにして雨水は土を酸性にし、同時に養分の少ない状態にしていきます。日本のように雨の多い国の土が酸性になりやすいのはこのためです。この場合、pHは低く、ミネラルなど塩基類も流されているのでECも低くなります。
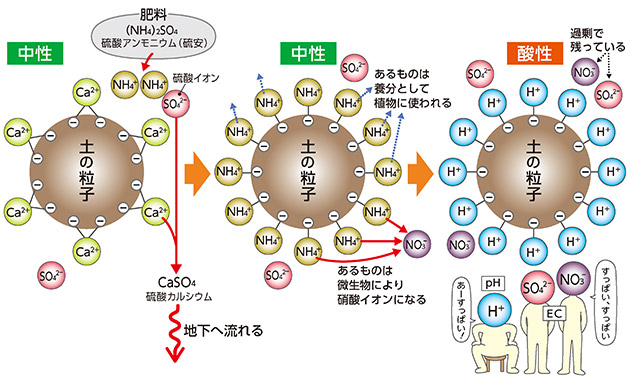
図9 化学肥料による土の酸性化
もう一つ土が酸性になる原因が、窒素肥料のやり過ぎによるものです。例えば硫酸アンモニウム(硫安)という肥料を施します。アンモニウムイオン(NH₄+)は陽イオンで土の粒子に吸着、つまり椅子に座った状態になります。アンモニウムイオンは養分として植物に使われるのに対して、硫酸イオン(SO₄²-)はほとんど使われず土壌に残ります。またアンモニウムイオンは、土の中の微生物によって硝酸イオン(NO3-)にもなります。土壌中の硫酸イオンや硝酸イオンは土の粒子の表面のカルシウムやマグネシウムなどのアルカリ性の陽イオンである塩基類を溶かし、結合して地下へ流れていきます。土の粒子表面の塩基類が抜けて空いた椅子には水素イオンが座り、土はますます酸性化していきます。この場合は、pHは低いものの、過剰な硫酸や硝酸イオンなどが残っているのでECは高くなります。
同じpHの低い酸性の状態でも、酸性化の生い立ちが違うとECは低くなったり高くなったりします。それに伴い、肥料の施し方も変わります。次回は肥料の施し方に迫ります。

次回は「渡る世間も土次第[その2] ~見えないところの状態が表に出るのです~」です。お楽しみに。



